- Autor Rachel Wainwright [email protected].
- Public 2023-12-15 07:40.
- Ostatnio zmodyfikowany 2025-11-02 20:14.
Od wirusa brodawczaka ludzkiego po raka narządów płciowych
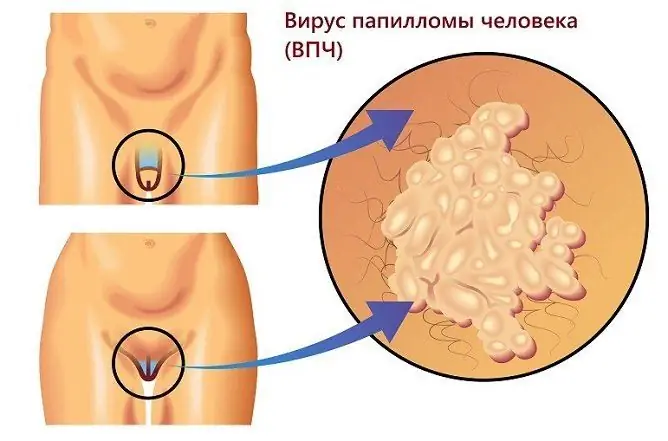
Nowotwory złośliwe narządów płciowych są poważnym problemem społecznym i medycznym [1]. Rak prącia, złośliwa formacja zlokalizowana w tkankach męskiego narządu rodnego, występuje w Rosji z częstością 0,1-7,9 na 100 000 mężczyzn, podczas gdy w strukturze częstości występowania nowotworów złośliwych patologia ta wynosi 0,23% [12]. Jest to dość „groźny” proces, w którym śmiertelność pacjentów nieleczonych w ciągu 3 i 5 lat wynosiła odpowiednio 93,7% i 97,4% [14]. Według szacunków WHO rak prącia stanowi około 0,5% wszystkich nowotworów u mężczyzn. Rak szyjki macicy jest drugim, aw niektórych krajach pierwszym najczęściej występującym nowotworem złośliwym po raku piersi, dotykającym młode kobiety [15]. Każdego roku na całym świecie diagnozuje się ponad 500 tysięcy osób.nowe przypadki raka szyjki macicy, co 2 minuty jedna kobieta na świecie umiera na raka szyjki macicy. Rak sromu i pochwy w Rosji stanowi do 5% wszystkich przypadków raka okolicy odbytu i narządów płciowych [13].

Terytorialny związek między rakami szyjki macicy, sromem, pochwą i prąciem, a także korespondencja między tymi typami nowotworów u par małżeńskich skłoniła do spekulacji na temat ich wspólnej etiologii. Udowodniono, że istotną rolę w tym odgrywa pokonanie wirusa brodawczaka ludzkiego (HPV). Obecnie różne typy wirusa HPV są klasyfikowane ze względu na ich onkogenność [15]. Zatem HPV typu 16 i 18 są przyczyną 38% wszystkich przypadków raka prącia, aw podstawowych i brodawkowatych odmianach raka odsetek ten sięga 90% [1]. Około 70% wszystkich przypadków raka szyjki macicy na świecie jest również wywoływanych przez HPV typu 16 i 18. HPV typu 16 i 18 są przyczyną ponad 30% przypadków raka sromu i ponad 50% przypadków raka pochwy. Ale musisz zrozumieć, że „onkogenność” jest pojęciem względnie warunkowym. Tak więc prawie co dziesiąty przypadek raka pochwy i 5% przypadków raka prącia jest powodowanych przez HPV 6 i 11, które są nisko onkogenne [14]. Innym przykładem jest guz Buschkego-Levenshteina (Condyloma tagigantea), który jest rzadkim, ale niebezpiecznym wzorcem wzrostu, który silnie koreluje z identyfikacją typów HPV „niskiego ryzyka” [4].
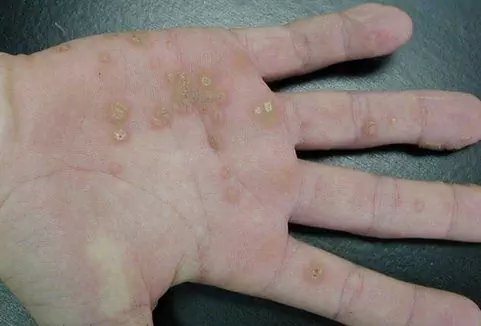
Nie ma wątpliwości, że nie każda osoba jest „zarażona” HPV, nie każda osoba zakażona ma przetrwałego wirusa objawiającego się klinicznie w postaci brodawczaków, a nie u każdego pacjenta z brodawkami narządów płciowych ostatecznie rozwija się złośliwy proces onkologiczny. W związku z tym można przypuszczać, że istnieje pewne wspólne „słabe” ogniwo w reaktywności organizmu, którego nasilenie warunkuje dalszy rozwój zakażenia HPV. Opierając się na nowoczesnych koncepcjach, ogniwem tym jest właśnie odporność systemowa i lokalna [16]. Po naturalnym zakażeniu HPV obserwuje się niski wskaźnik serokonwersji i niski poziom wytwarzania przeciwciał przeciwko HPV: z reguły przeciwciała powstałe po zakażeniu jednym rodzajem patogenu nie zapobiegają zakażeniu innymi typami HPV [6]. Infekcja wirusem brodawczaka ludzkiego może być klinicznie oczywista, subkliniczna lub utajona. Okres inkubacji wynosi średnio do 3 miesięcy. W zakażonej komórce wirus występuje w dwóch formach: episomalnej (poza chromosomami komórki), która jest uważana za łagodną, i introsomalnej (zintegrowanej, „osadzonej” w genomie komórki) - złośliwej. Mechanizm rozwoju chorób onkologicznych związanych z HPV związany jest z ekspresją białek E7 i E6, które inaktywują białko siatkówczaka i niszczą białko p53, co prowadzi odpowiednio do niekontrolowanego podziału komórek i akumulacji mutacji w komórkowym DNA [5]. Bezpośrednio sam wirus jest zdolny do tłumienia lokalnej odporności komórkowej w ognisku zmiany i prowadzi do osłabienia rozpoznawania komórek rakotwórczych przez limfocyty T zabójców [11].subkliniczne lub utajone. Okres inkubacji wynosi średnio do 3 miesięcy. W zakażonej komórce wirus występuje w dwóch formach: episomalnej (poza chromosomami komórki), która jest uważana za łagodną, i introsomalnej (zintegrowanej, „osadzonej” w genomie komórki) - złośliwej. Mechanizm rozwoju chorób onkologicznych związanych z HPV związany jest z ekspresją białek E7 i E6, które inaktywują białko siatkówczaka i niszczą białko p53, co prowadzi odpowiednio do niekontrolowanego podziału komórek i akumulacji mutacji w komórkowym DNA [5]. Bezpośrednio sam wirus jest zdolny do tłumienia lokalnej odporności komórkowej w ognisku zmiany i prowadzi do osłabienia rozpoznawania komórek rakotwórczych przez T-zabójców [11].subkliniczne lub utajone. Okres inkubacji wynosi średnio do 3 miesięcy. W zakażonej komórce wirus występuje w dwóch formach: episomalnej (poza chromosomami komórki), która jest uważana za łagodną, i introsomalnej (zintegrowanej, „osadzonej” w genomie komórki) - złośliwej. Mechanizm rozwoju chorób onkologicznych związanych z HPV związany jest z ekspresją białek E7 i E6, które inaktywują białko siatkówczaka i niszczą białko p53, co prowadzi odpowiednio do niekontrolowanego podziału komórek i akumulacji mutacji w komórkowym DNA [5]. Bezpośrednio sam wirus jest zdolny do tłumienia lokalnej odporności komórkowej w ognisku zmiany i prowadzi do osłabienia rozpoznawania komórek rakotwórczych przez T-zabójców [11]. W zakażonej komórce wirus występuje w dwóch formach: episomalnej (poza chromosomami komórki), która jest uważana za łagodną, i introsomalnej (zintegrowanej, „osadzonej” w genomie komórki) - złośliwej. Mechanizm rozwoju chorób onkologicznych związanych z HPV związany jest z ekspresją białek E7 i E6, które inaktywują białko siatkówczaka i niszczą białko p53, co prowadzi odpowiednio do niekontrolowanego podziału komórek i akumulacji mutacji w komórkowym DNA [5]. Bezpośrednio sam wirus jest zdolny do tłumienia lokalnej odporności komórkowej w ognisku zmiany i prowadzi do osłabienia rozpoznawania komórek rakotwórczych przez T-zabójców [11]. W zakażonej komórce wirus występuje w dwóch formach: episomalnej (poza chromosomami komórki), która jest uważana za łagodną, i introsomalnej (zintegrowanej, „osadzonej” w genomie komórki) - złośliwej. Mechanizm rozwoju chorób onkologicznych związanych z HPV związany jest z ekspresją białek E7 i E6, które inaktywują białko siatkówczaka i niszczą białko p53, co prowadzi odpowiednio do niekontrolowanego podziału komórek i akumulacji mutacji w komórkowym DNA [5]. Bezpośrednio sam wirus jest w stanie hamować lokalną odporność komórkową w ognisku zmiany i prowadzić do osłabienia rozpoznawania komórek rakotwórczych przez T-zabójców [11]. Mechanizm rozwoju chorób onkologicznych związanych z HPV związany jest z ekspresją białek E7 i E6, które inaktywują białko siatkówczaka i niszczą białko p53, co prowadzi odpowiednio do niekontrolowanego podziału komórkowego i akumulacji mutacji w komórkowym DNA [5]. Bezpośrednio sam wirus jest zdolny do tłumienia lokalnej odporności komórkowej w ognisku zmiany i prowadzi do osłabienia rozpoznawania komórek rakotwórczych przez T-zabójców [11]. Mechanizm rozwoju chorób onkologicznych związanych z HPV związany jest z ekspresją białek E7 i E6, które inaktywują białko siatkówczaka i niszczą białko p53, co prowadzi odpowiednio do niekontrolowanego podziału komórek i akumulacji mutacji w komórkowym DNA [5]. Bezpośrednio sam wirus jest zdolny do tłumienia lokalnej odporności komórkowej w ognisku zmiany i prowadzi do osłabienia rozpoznawania komórek rakotwórczych przez T-zabójców [11]. Bezpośrednio sam wirus jest zdolny do tłumienia lokalnej odporności komórkowej w ognisku uszkodzenia i prowadzi do osłabienia rozpoznawania komórek rakotwórczych przez T-zabójców [11]. Bezpośrednio sam wirus jest zdolny do tłumienia lokalnej odporności komórkowej w ognisku zmiany i prowadzi do osłabienia rozpoznawania komórek rakotwórczych przez limfocyty T zabójców [11].

Ogólny związek między zakażeniem HPV a nowotworami narządów płciowych i innych obszarów skóry odnotowuje się w szczególności w podejściach do leczenia tych nozoologii. Na przykład, zarówno rosyjskie, jak i oficjalne zalecenia wielu innych krajów dotyczące leczenia chorób związanych z zakażeniem HPV obejmują lek imichimod. Lek imikwimod jest szeroko stosowany na świecie ze względu na łatwość stosowania, skuteczność oraz możliwość łączenia z innymi środkami leczenia powikłanych chorób HPV. Co ciekawe, imikwimod został przetestowany w leczeniu różnych nowotworów złośliwych skóry - raka płaskonabłonkowego, raka podstawnokomórkowego, raka czerniaka, a także nowotworów przedrakowych - rogowacenia [7, 8, 9].
Jeśli zwrócimy się do autorytatywnej bazy publikacji medycznych i biologicznych utworzonej przez National Center for Biotechnology Information w USA Pubmed, to istnieje około 3200 publikacji dotyczących stosowania samego leku „imikwimod”, podczas gdy w świetle leczenia raka liczba artykułów naukowych „rak + imichimod” przekracza 1500 [dziesięć]. Potwierdza to możliwe ogólne mechanizmy tłumienia przez imikwimod zarówno samej infekcji wirusem brodawczaka, jak i związanych z nią nowotworów złośliwych.
Skuteczność przeciwwirusowego i przeciwnowotworowego działania imichimodu wynika z jego zdolności do interakcji z komórkami plazmatycznymi, które są głównymi producentami IFN typu 1, w szczególności IFNα. Jednocześnie IFN typu 1 aktywują produkcję kaskady cytokin prozapalnych, takich jak TNF-α, IL-1β, IL-5, -6, -8, -12. Działanie przeciwnowotworowe imikwimodu objawia się również zahamowaniem wzrostu guza przez naczynia włosowate. Ważną właściwością imichimodu w leczeniu HPV i nowotworów jest również jego proapoptotyczne działanie związane z rekrutacją wewnątrzkomórkowego czynnika białkowego - regulatora apoptozy Bcl-2 oraz wzrostem ekspresji Bcl-2 i Bcl-xL, inicjującym śmierć komórki. W mechanizmie działania przeciwwirusowego i przeciwnowotworowego decydującą rolę odgrywa zdolność imichimodu do promowania infiltracji zmian tkankowych przez komórki immunokompetentne [6].
Tak więc obecnie istnieje skuteczny lek do stosowania miejscowego, który może nie tylko pomóc w leczeniu objawów klinicznych HPV i zmniejszyć utrzymywanie się wirusa w organizmie, ale także wpływać na rozwój procesów patologicznych leżących u podstaw karcynogenezy związanych z zakażeniem wirusem brodawczaka.
Źródła literaturowe
- Wytyczne NCCN wersja 1.2013 Rak prącia.//
- Matveev B. P., Khalafyan E. A., Volkova M. I. Zachowujące narządy leczenie raka prącia. // Urologia. 2004 - nr 2 - str. 26-30.
- Ornellas AA, Seixas AL, Marota A i wsp. Chirurgiczne leczenie inwazyjnego raka płaskonabłonkowego prącia: analiza retrospektywna 350 przypadków. J Urol 1994; 151 (5): 1244-1249,1
- Yanofsky VR, Patel RV, Goldenberg G: brodawki narządów płciowych: kompleksowy przegląd. J Clin Aesthet Dermatol 2012; 5: 25-36.
- Castle PE, Schiffman M, Herrero R, Hildesheim, Rodriguez AC, Bratti MC J Infect Dis. 2005; 191: 1808-1816.
- Schön MP, Bong AB, Drewniok C. Selektywna indukcja apoptozy w guzie i drobnocząsteczkowy modyfikator odpowiedzi immunologicznej imikwimod. J. nat. Cancer 2003; 95 (15): 1138-1149.
- Siegel JA Korgavkar K., mgr Weinstock Aktualne spojrzenie na rogowacenie słoneczne: przegląd. Brit. J. Dermatol. 2016: doi: 10.1111 / bjd.14852.
- Longo C., Pellacani G. Dermatol. Clin. 2016; 34 (4): 411-419.
- Griffi n LL, Rehman AF, Ali B., Lear JT Nonmelanoma skin cancer. Clin. 2016; 16 (1): 62-65.
- Baza publikacji medycznych i biologicznych - Pubmed.
-
Fayzullina E. V. Kliniczne i organizacyjne aspekty opieki medycznej nad pacjentami z brodawkami odbytowo-płciowymi jako najważniejszy czynnik zachowania zdrowia reprodukcyjnego populacji.
Faizullina, D. V. Frizin, L. K. Bunakova // Medycyna praktyczna. - 2012 - nr 9 (65). - S. 170-174.
- Grandolfo M i Milani M. Skuteczność i tolerancja polifenonu E w „trudnych do leczenia” brodawkach mnogich narządów płciowych u mężczyzn zakażonych wirusem HIV Case Rep Dermatol 2017; 9: 5-59.
- Werner RN, Westfechtel L, Dressler C i wsp. Brodawki odbytowo-płciowe i inne zmiany odbytowo-płciowe związane z HPV u pacjentów zakażonych wirusem HIV: systematyczny przegląd i metaanaliza skuteczności i bezpieczeństwa interwencji ocenianych w kontrolowanych badaniach klinicznych. Sex Transm Infect 2017; 93: 543-550
- Smith KJ, Skelton HG, Yeager J i wsp. Zwiększone reakcje na lek u pacjentów zakażonych HIV-1: możliwe wyjaśnienie oparte na wzorcach rozregulowania odporności obserwowanego w chorobie HIV-1. Clin Exp Dermatol 1997; 22: 118-123.
- Godley MJ, Bradbeer CS, Gellan M i wsp. Krioterapia w porównaniu z kwasem trójchlorooctowym w leczeniu brodawek narządów płciowych. Genitourin Med 1987; 63: 390-2 /
Znalazłeś błąd w tekście? Wybierz go i naciśnij Ctrl + Enter.